23.1 – Jodmetabolismus
- Jod ist ein Spurenelement
- Tagesbedarf an Jod: ca. 150µg, Schwangere und Stillende 200-250µg
- reiche Jodvorkommen in Küstengebieten, Jodmangel in Berggebieten oder Binnenländern (potentielle Gebiete für endemische Struma und endemischen Kretinismus)
- Vorkommen von Jod in Fisch, Meeresalgen, jodiertem Kochsalz, Medikamenten (z.B. Amiodaron), Röntgenkontrastmitteln u.a.
- Aufnahme von Jod → Jodid → Extrazellilärflüssigkeit (Jodid-Pool) → Follikelepithelzellen (Bindung an Thyreoglobulin)
- Gleichgewicht zwischen Jodaufnahme und Jodausscheidung. Jodausscheidung im 24-Stunden-Urin entspricht ca. 70-80% der Jodaufnahme
23.2 – Struktur und Synthese der Schilddrüsenhormone
23.2.1 – Schritte der Schilddrüsenhormonsynthese
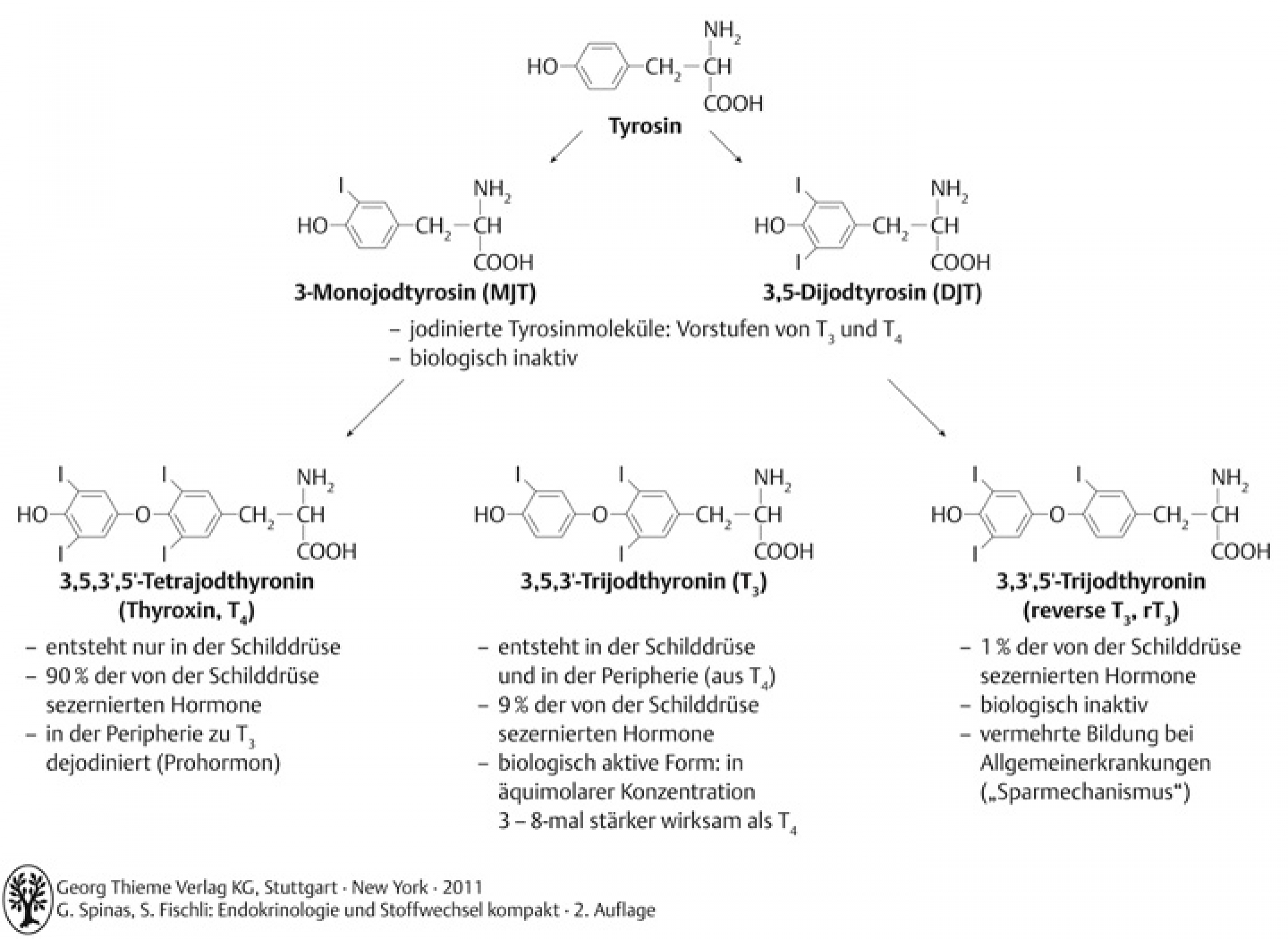
- Ausgangssubstanz der Hormonsynthese: Tyrosin
- Synthese im Follikellumen, an den 140 Tyrosinresten von Thyreoblobulin (TG, dimeres Glykoprotein).
- TSH stimuliert Transkription des Thyreoglobulin-Gens.
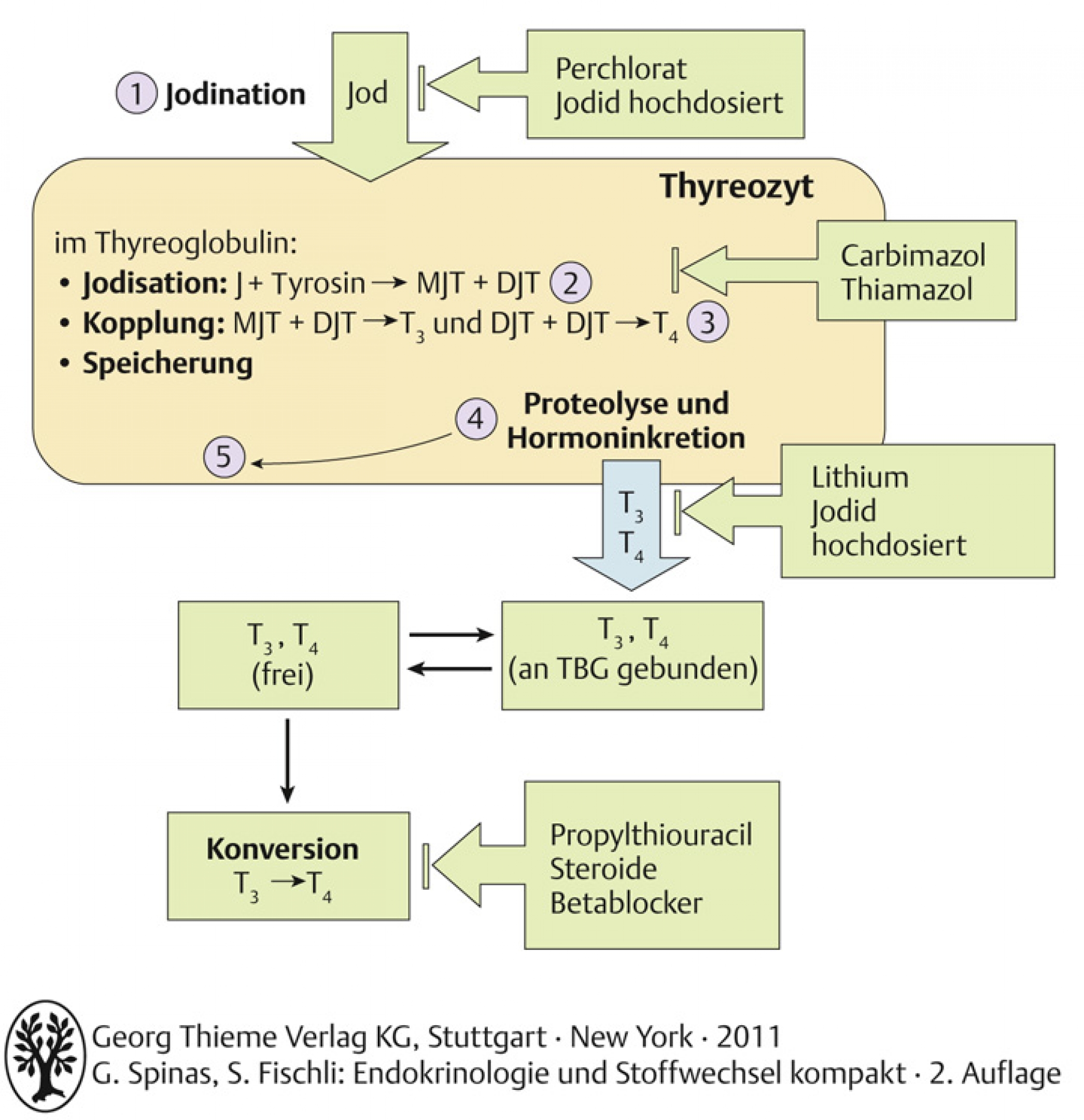
- Thyreoperoxidase (TPO) katalysiert Hormonsynthese
MERKE
Die Thyreoperoxidase wird gehemmt durch:
- Propylthiouracil, Thiamazol und Carbimazol
- werden als Thyreostatika zur Therapie der Hyperthyreose eingesetzt
Perchlorat (ClO4–) kann zur Therapie der thyreotoxischen Krise oder der jodinduzierten Hyperthyreose eingesetzt werden. Es entleert den Jodspeicher und hemmt weitere Jodaufnahme.
Natrium-Pertechnetat Tc 99m ist ein y-Strahler. Er wird in zur Szintigraphie der Schilddrüse verwendet.
23.3 – Hormontransport
- nur 0.04% des T4 und 0.4% des T3 sind ungebunden: entsprechen dem «freien» Anteil (fT4 bzw. fT3)
- das freie Hormon ist für die Hormonwirkung verantwortlich
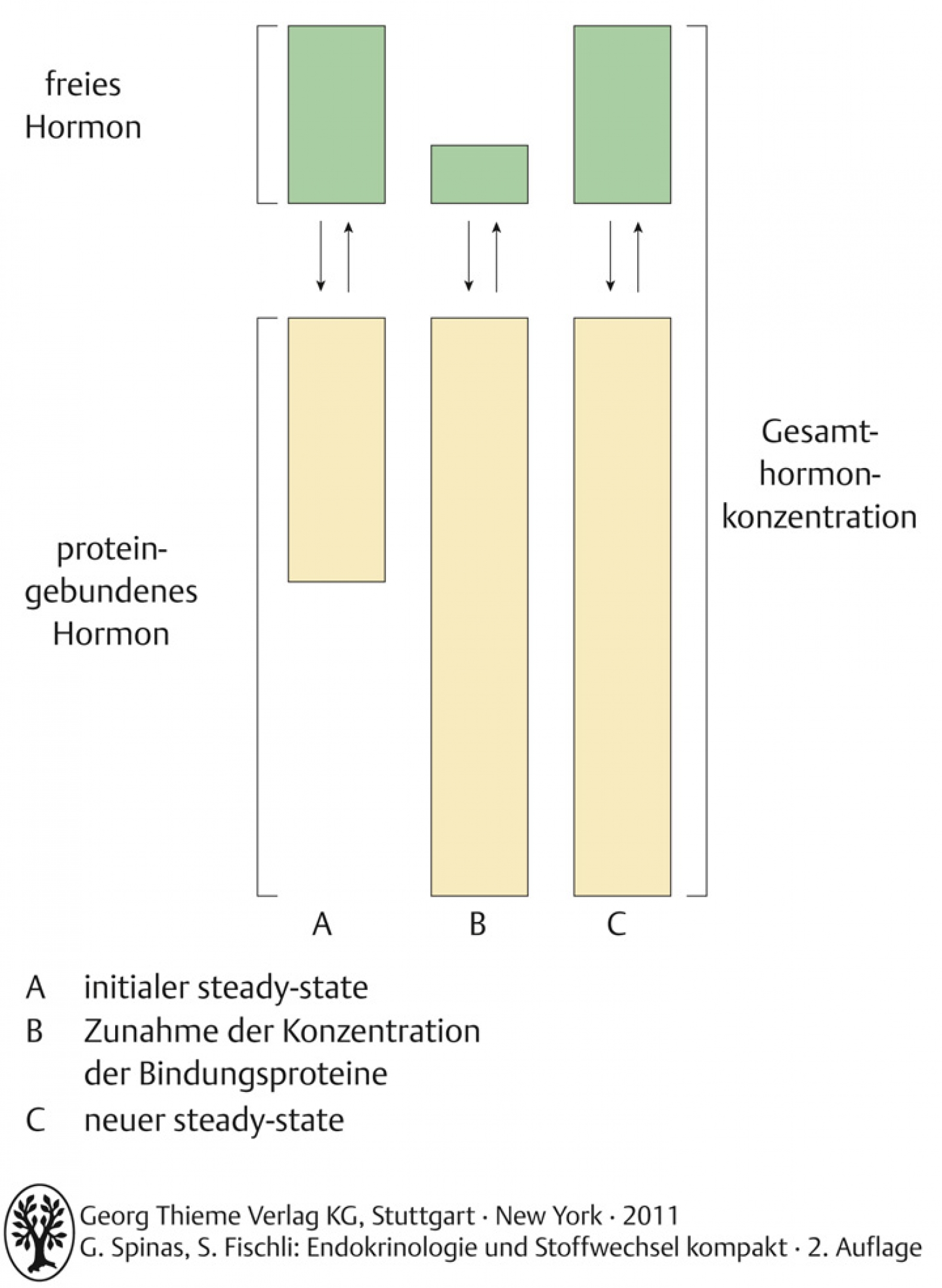
- Gleichgewicht zwischen gebundenem und freiem Anteil
- Änderungen der Bindungsproteinkonzentrationen führen zu veränderten Gesamthormonkonzentrationen
- die Schilddrüsenhormone sind an drei Transport- bzw. Bindungsproteine gebunden
- thyroxinbindendes Globulin (TGB, bindet 75% der Schilddrüsenhormone)
- thyroxinbindendes Präalbumin (TBPA = Transthyretin, bindet 10% des T4)
- Albumin (bindet 15% der Schilddrüsenhormone, rasche Dissoziation, setzt Hormone in der Peripherie frei)
- Änderungen der Konzentration der Bindungsproteine verändert Gesamtkonzentration der Hormone
- Östrogene (orale Antikonzeption, Schwangerschaft) erhöhen die TBG-Konzentration
- schwere Systemerkrankungen (z.B. Leberzirrhose) vermindern TBG-Konzentration
- der freie Hormonanteil bleibt jedoch unverändert
MERKE
Bestimmte Medikamente wie z.B. Salizylate, Diazepam oder Phenytoin könnten an TBG binden und an TBG gebundene Schilddrüsenhormone verdrängen. Dadurch steigt der “freie” Hormonanteil im Serum an.
23.4 – Metabolismus der Schilddrüsenhormone
23.4.1 – Sekretion
- tägliche Sekretion von Schilddrüsenhormonen:
T4: 100 nmol/d;
T3: 5 nmol/d;
rT3: < 5 nmol/d
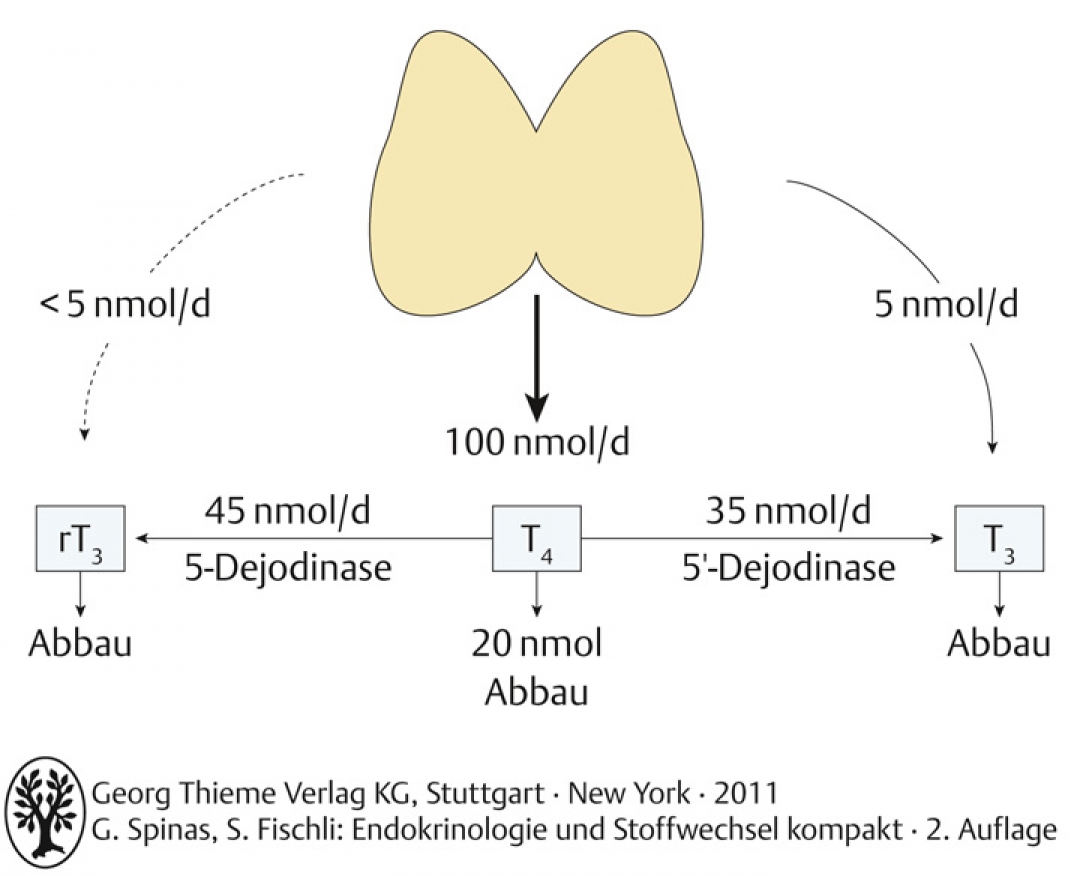
Abb. A-3.6 Übersicht über Metabolismus der Schilddrüsenhormone
- grösster Anteil von fT3 entsteht durch Dejodinierung von T4 in der Peripherie
- Art der Dejodinierung von T4 bestimmt biologische Aktivität:
- 5’-Dejodinierung führt zu biologisch aktivem T3: “step-up”-Prozess
- 5-Dejodinierung führt zu biologisch inaktivem reverse T3 (rT3): “step-down”-Prozess
- verschiedene Faktoren können zu einer verminderten Konversion von T4 zu T3 führen (fetales Leben, schwere Systemerkrankungen, Medikamente)
- es gibt drei Typen von Dejodinasen welche gewebe- und substratspezifisch sind
- 80% des T4 wird durch Dejodinierung metabolisiert: 35% zu T3 und 45% zu rT3. 20% des T4 wird durch Glukuronidierung, Sulfonidierung, Deaminierung und Dejodinierung in Leber und Niere inaktiviert
- Plasma-Halbwertszeiten der verschiedenen Hormone :
– für T4: 7 Tage
– für T3: 1 Tag
– für rT3: 4.5 Stunden
23.5 – Mechanismen der Regulation der Schilddrüsenfunktion
23.5.1 – Dejodinasen in Peripherie und Hypophyse
23.5.2 – Hypothalamus-Hypophysen-Schilddrüsen-Achse
TRH aus dem Hypothalamus stimuliert Freisetzung von TSH aus dem Hypophysenvorderlappen
TSH wirkt über den G-Protein-gekoppelten-TSH Rezeptor stimulierend auf:
- Wachstum und Vaskularisierung der Schilddrüse
- Thyreoglobulinsynthese
- alle Schritte der Hormonsynthese: Jodaufnahme → Jodisation von Thyreoglobulin
- Sekretion der Hormone: Proteolyse von Thyreoglobulin
- Expression verschiedener Gene im Schilddrüsengewebe ( z.B. TPO)
Negatives Feedback:
T3 und T4 hemmen TRH- und TSH-Freisetzung im Hypothalamus bzw. Hypophyse (Abb. A-3.7).
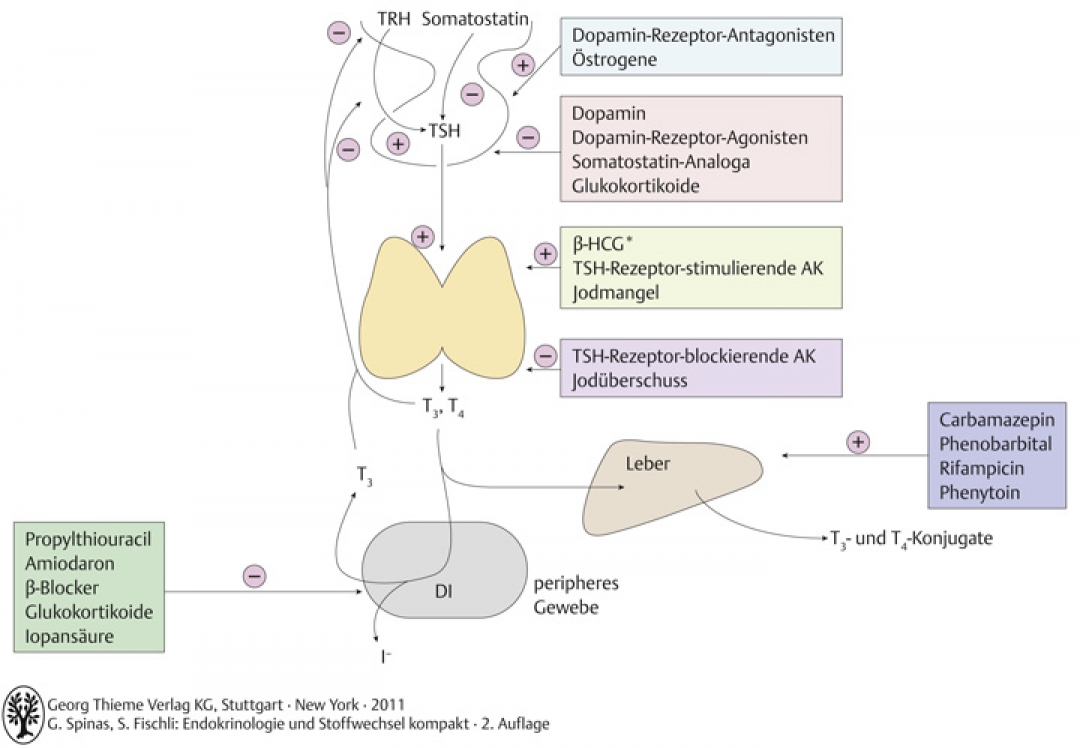
Abb. A-3.7 Einflussfaktoren auf Synthese, Sekretion und Metabolismus der Schilddrüsenhormone. DI: 5′ Dejodinase (T4 T3), * in grosser Konzentration
23.5.3 – Autoregulation über das Jodangebot
Die Schilddrüse passt ihre Funktion an die Verfügbarkeit von Jod (Mangel/Überschuss) an
→ dieser Anpassungsmechanismus wird durch TSH NICHT beeinflusst.
WICHTIG
Wirkung von Jod-Mangel auf Hormonsynthese
- erhöht die Jodaufnahme
- erhöht Synthese von T3
- vermehrte Dejodinierung von T4 zu T3 (verminderte Sekretion von T4)
WICHTIG
Wirkung von Jod-Überschuss auf Hormonsynthese
- Wolff-Checkoff-Effekt: Permanenter Jod-Überschuss bei normaler Schilddrüsenfunktion hemmt Jodaufnahme und Hormonsynthese
- nach 2-4 Wochen setzt ein Escape-Phänomen ein: Hemmung der Hormonsynthese fällt weg → Schilddrüse produziert trotz Jod-Überschuss weiter Hormone
- Wolff-Chaikoff-Effekt wird therapeutisch genutzt: Pummerung der Schilddrüse mit Jodid-haltiger Lösung (Lugolsche Lösung)
- bei gestörter Schilddrüsenfunktion versagt der Escape Mechanismus (z.B. Hashimoto Thyreoiditis, St. n. Radiojodablation oder partieller Thyreoidektomie) → jodinduzierte Hypothyreose
- Jodmangelstruma, Knotenstruma und autonome Adenome: Entwicklung einer jodinduzierten Hyperthyreose nach Wochen bis Monaten
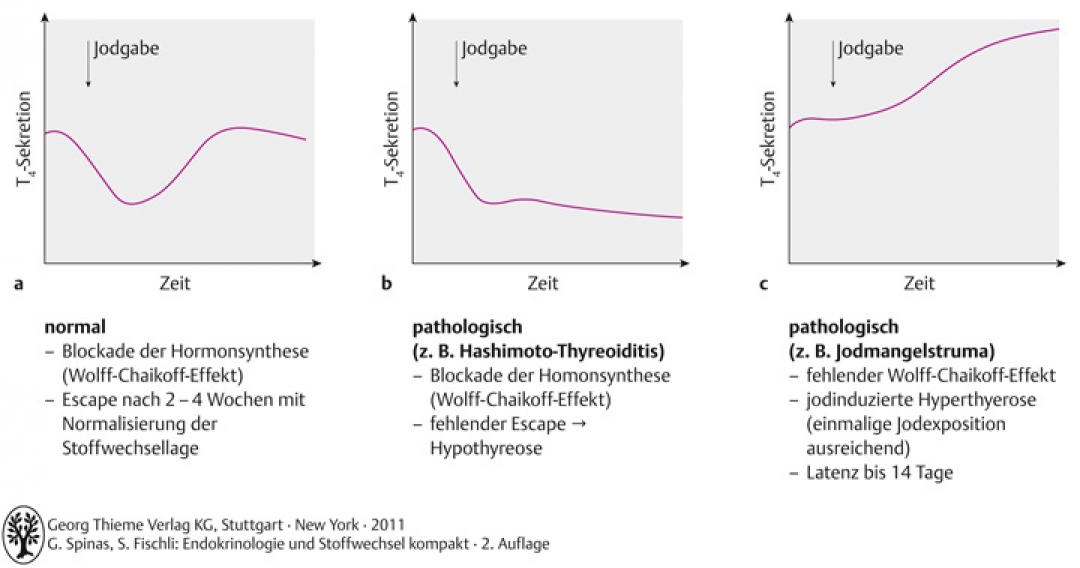
Abb. A-3.8 Wirkung von Jod auf die Schilddrüsenhormonsynthese bei normaler Funktion (a) und bei pathologischen Veränderungen (b, c)
23.5.4 – TSH-Rezeptor-Antikörper
Bei autoimmunen Schilddrüsenerkrankungen können Autoantikörper gebildet werden.
- stimulierende AK: Autoimmunhyperthyreose Morbus Basedow
- hemmende AK: chronische autoimmune Thyreoiditis Hashimoto, blockierende Antikörper bei Morbus Basedow
23.6 – Wirkungen der Schilddrüsenhormone
23.7 – Charakteristika des Schilddrüsenhormon-Rezeptors
- Schilddrüsenhormone wirken über nukleäre Rezeptoren (Schilddrüsenhormonrezeptor, TP)
- strukturell verwandt mit Steroidhormonrezeptoren
- TR hat Domäne für Bindung von T3 und DNA
- Affinität des TR ist 15x höher für T3 als für T4
- T3 bindet an Zellkernrezeptor → Inhibierung/Stimulation der Transkription gewisser Gene (durch Aktivierung/Hemmung der RNA-Polymerase) → mRNA → Protein → Effekte
- Mutationen im TR-Gen führen zu Syndromen mit Schilddrüsenhormonresistenzen
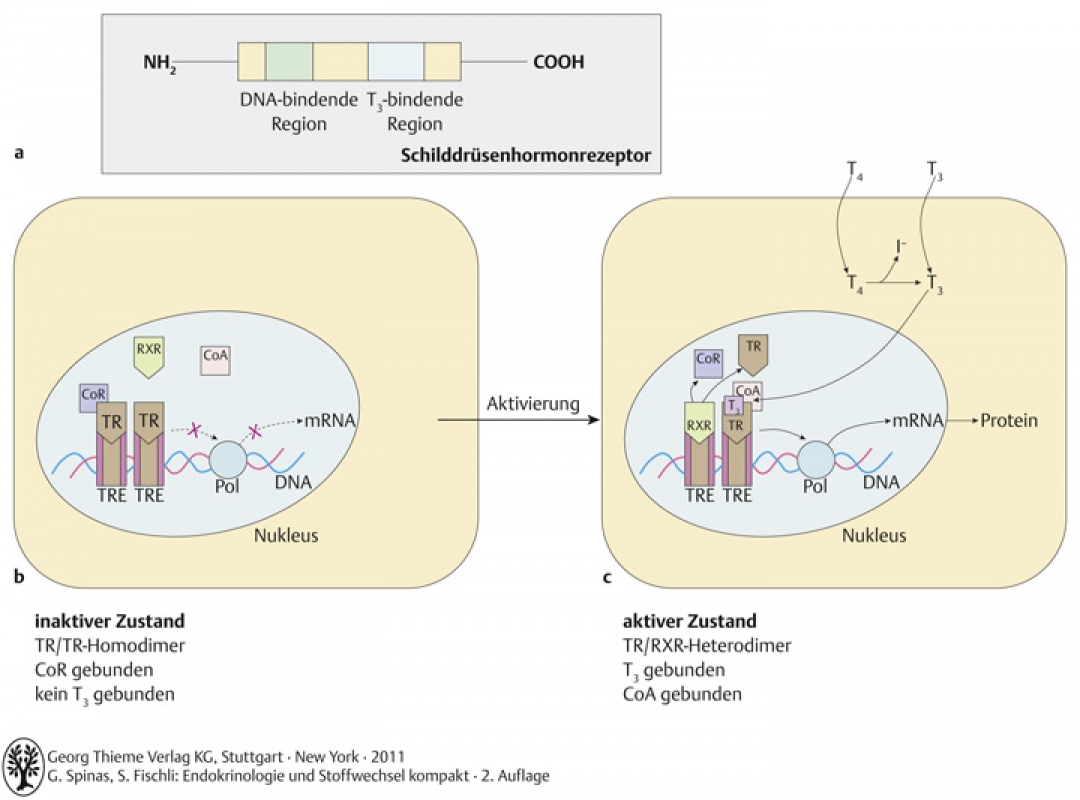
Abb. A-3.9 a Schilddrüsenhormonrezeptor, b inakitver Zustand, c aktiver Zustand
T3 diffundiert ins Zellinnere, bindet dort an den TR und beeinflusst so die Gentranskription.
Abkürzungen: CoR: Korepressor, CoA: Koaktivator, TR: Schilddrüsenhormonrezeptor, RXR: Retinoid X Rezeptor
MERKE
Aktivierung bzw. Hemmung von Genen führt erst nach Stunden bis Tagen zu messbaren zellulären Veränderungen.
Die Wirkungen der Schilddrüsenhormone treten deshalb erst nach einer Latenzzeit auf.