2.1 – Hin- und Rückreaktionen:
Chemische Reaktionen spielen in der Biologie eine wichtige Rolle. Beispielsweise kann ein Molekül wie DNA (X) mit einem Protein (A) reagieren. DNA besteht aus einer Doppelhelix ([latex]X_2[/latex]); Proteine bilden häufig Polymere, z.B. ein Dimer ([latex]A_2[/latex]). Betrachten wir die Reaktion der Aufspaltung der DNA durch ein Proteindimer, bei welchem ein Proteinmonomer kovalent einen DNA-Strang bindet. Somit kann folgende Reaktionsgleichung aufgestellt werden: [latex]A_2+X_2\rightarrow 2\,AX[/latex]. Viele dieser Reaktionen können nicht nur in eine Richtung, sondern auch in die entgegengesetze Richtung ablaufen. Die entstandenen Produkte können dadurch wieder zu den Edukten zurückreagieren: [latex]2AX\rightarrow A_2+X_2[/latex].
Mit [latex]A_2+X_2\rightarrow 2 AX[/latex], also die Reaktion, die zu den Produkten hin verläuft, bezeichnet man als Hinreaktion. Während [latex]2AX\rightarrow A_2+X_2[/latex], die entsprechende Rückreaktion, zu den Edukten zurückführt. Die Gesamtreaktion bestehend aus Hin- und Rückreaktion kann auch als [latex]A_2+X_2 \rightleftharpoons 2\,AX[/latex] geschrieben werden.
Die Geschwindigkeit, mit welcher diese Reaktionen ablaufen, kann man bei der Hinreaktion als Veränderung der Konzentration eines der Edukte über die vergangene Zeit wie folgt definieren:
Zur Vereinfachung der Berechnung der Geschwindigkeit bei bekannten Konzentrationen wird die sogenannte Geschwindigkeitskonstante [latex]k_{hin}[/latex] eingesetzt.
Mit der gleichen Logik lässt sich auch die Geschwindigkeit der Rückreaktion definieren. Dabei muss beachtet werden, dass wegen [latex]2 AX[/latex] der stöchiometrische Koeffizient als Exponent bei der Konzentration geschrieben wird:
\[v_{rück}=k_{rück}\cdot c^2(AX)\]
Allerdings wird bei dieser Definition der Geschwindigkeiten die gegenseitige Beeinflussung der Edukte und der Produkte nicht berücksichtigt. Unter realen Bedingungen beeinflussen sich die Hin- und Rückreaktionen und nach einiger Zeit wird sich ein Gleichgewicht einstellen, welches im nächsten Abschnitt behandelt wird.
2.2 – Herleitung der Gleichgewichtskonstante K:
Wenn sowohl Hin- als auch Rückreaktion mit der gleichen Geschwindigkeit ablaufen und die Konzentrationen der Reaktanden konstant bleiben, spricht man von einem sogenannten chemischen Gleichgewicht. Dies trifft in Abbildung 2.1 ab dem Zeitpunkt [latex]t_G[/latex] ein. Ab diesem Zeitpunkt bleiben die Konzentrationen von allen beteiligten Stoffen [latex]AX[/latex], [latex]A_2[/latex] und [latex]X_2[/latex] konstant (Abbildung 2.1).
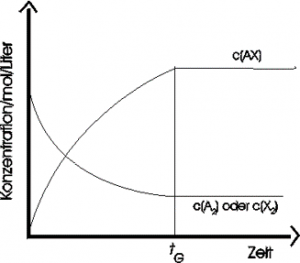
Abbildung 2.1 – Verlauf einer chemischen Reaktion, die nach der Zeit [latex]t_G[/latex] im chemischen Gleichgewicht ist. (Illustration von http://www.guidobauersachs.de/allgemeine/MWG, Stand: 04.06.2020)
Im chemischen Gleichgewicht bleiben die Konzentrationen konstant, d.h. die Konzentrationsänderung, welche der Ableitung der Konzentration nach der Zeit entspricht, ist gleich 0. Man kann also die Konzentrationen von z.B. [latex]A_2[/latex] im chemischen Gleichgewicht wie folgt beschreiben:
\[-\frac{dc(A_2)}{dt}=-v_{hin}+v_{rück}=0.\]
Mit Einsetzen von [latex]v_{hin}[/latex] und [latex]v_{rück}[/latex] ergibt sich:
\[-\frac{dc(A_2)}{dt}=-k_{hin}\cdot c(A_2)\cdot c(X_2)+k_{rück}\cdot c^2(AX)=0\]
Dabei berücksichtigen wir nun auch den Einfluss der Rückreaktion auf die Konzentration von [latex]A[/latex]. Wenn wir ein chemisches Gleichgewicht annehmen, dann ist die Hinreaktion gleich schnell wie die Rückreaktion. Es gilt also:
\[v_{hin}=v_{rück}\]
Dieser Zustand des chemischen Gleichgewichts lässt sich durch das Massenwirkungsgesetz beschreiben:
\[k_{hin}\cdot c(A_2)\cdot c(X_2)=k_{rück}\cdot c^2(AX)\]
Durch Umformen ergibt sich:
[latex]K[/latex] ist dabei die Gleichgewichtskonstante der Reaktion und ist für jede chemische Reaktion individuell. Die Gleichgewichtskonstante gibt also das Verhältnis der Mengen der bei einer chemischen Reaktion beteiligten Stoffe wieder, bei welchem kein Nettofluss stattfindet. Je grösser die Gleichgewichtskonstante [latex]K[/latex] ist, desto schneller läuft die Hinreaktion ab und desto mehr Edukt reagiert zum Produkt.
2.3 – Allgemeine Formulierung des Massenwirkungsgesetzes:
Es gibt jedoch auch viele Reaktionen, die mehr als zwei Reaktanden beinhalten. Die Definition der Gleichgewichtskonstante lässt sich dann anhand des allgemeinen Massenwirkungsgesetzes für allgemeine Reaktion erfassen: